Cambios de estado
¿Cuáles son los estados de la materia?
Los estados de la materia son las diversas formas en que se presenta la materia en el universo. Se conocen también como estados de agregación de la materia, ya que las partículas se agregan o agrupan de maneras diferentes en cada estado.
Se puede considerar que existen cuatro estados fundamentales de la materia, tomando en cuenta aquellas formas de agregación que se presentan bajo condiciones naturales. Los estados fundamentales de la materia son:
- Estado sólido.
- Estado líquido.
- Estado gaseoso.
- Estado plasmático.
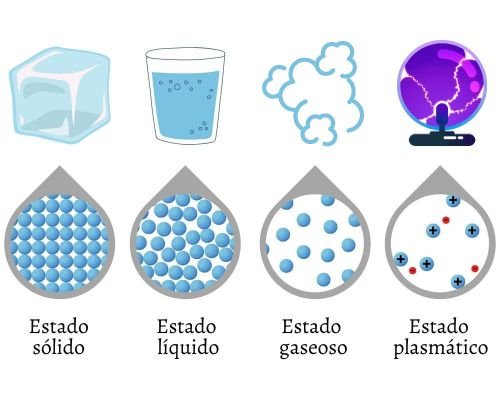
En el detalle de la imagen, observamos cómo se agrupan las partículas.
Sin embargo, los estudios sobre los estados de agregación de la materia se han extendido en la actualidad. Además de aquellos que se presentan naturalmente, hoy se estudian aquellos que se presentan en condiciones extremas, inducidas en laboratorio. De este grupo, los científicos han comprobado la existencia de tres nuevos estados: el condensado de Bose-Einstein (BEC); el condensado de Fermi y el supersólido.
Cambios de estado de la materia
Los cambios de estado de la materia se refieren a las transformaciones que sufre la materia de un estado al otro sin cambiar su composición. Estos cambios se producen cuando varían la presión y/o la temperatura.
En la Tierra, se manifiestan de forma natural los estados sólido, líquido, gaseoso y plasmático. Los cambios de estado que se dan entre estos son: vaporización, fusión, solidificación, sublimación, sublimación inversa, ionización y desionización.
Solidificación
La solidificación es el cambio del estado líquido al sólido. Se produce cuando desciende sensiblemente la temperatura de un líquido o fluido.
¿Cómo ocurre la solidificación? Cuando la temperatura del fluido desciende, las partículas se van aproximando unas a otras cada vez más, hasta quedar tan compactas que se reduce el movimiento entre ellas. Esta aproximación y falta de movilidad entre las partículas es lo que le da firmeza a los sólidos.
El punto máximo en el cual el fluido se endurece se conoce como punto de congelación.
Ejemplos
- Formación de hielo.
- Endurecimiento del chocolate.
- Endurecimiento de metales fundidos (joyas, herramientas de trabajo, etc.).
- Fabricación de jabones en pastilla.
- Endurecimiento de la gelatina.
Fusión o derretimiento
La fusión o derretimiento es el cambio del estado sólido al líquido. La fusión ocurre cuando el sólido se encuentra expuesto al aumento de la temperatura.
¿Cómo ocurre la fusión o el derretimiento? Cuando se eleva la temperatura de manera considerable, las partículas de la materia sólida comienzan a separarse unas de otras. A medida que la separación es mayor, las partículas ganan más movimiento. En consecuencia, la materia empieza a ganar un aspecto fluido y pierde su forma. Es decir, el sólido se convierte en líquido.
Ejemplos
- Deshielo de los casquetes polares.
- Chocolate fundido.
- Mantequilla derretida para cocinar.
- Cera de vela derretida (parafina).
- Derretimiento de helados en paleta expuestos al calor del ambiente.
Vaporización
La vaporización es el cambio del estado líquido al gaseoso. La vaporización ocurre cuando un líquido es expuesto a una elevación de la temperatura.
¿Cómo ocurre la vaporización? La vaporización es un proceso que avanza constante y lentamente en ciertos fluidos, pero se acelera cuando el líquido alcanza el punto de ebullición.
En dichas condiciones, las partículas empiezan a alejarse unas de otras. La interacción entre ellas se rompe y, por ende, su movimiento se hace expansivo, dando lugar a la formación del estado gaseoso.
Ejemplos
- Vapor de agua hirviendo.
- Secado de un piso húmedo.
- Evaporación del sudor.
- Secado de la ropa al aire libre.
- Formación de nubes por evaporación del agua terrestre.
Los términos evaporación o vaporización se aplican al paso del estado líquido al estado gaseoso. Cuando el fenómeno se produce únicamente en la superficie de la masa líquida se designa como evaporación. Si el paso a vapor tiene lugar afectando toda la masa líquida se denomina vaporización o ebullición.
De esta manera, ¿qué es la ebullición explicacion para niños?
Ebullición se refiere a la acción y efecto de hervir, que consiste en el proceso físico en el cual una sustancia pasa del estado líquido al gaseoso, a través del aumento de la temperatura en la totalidad de la masa líquida.
https://aleph.org.mx/que-diferencia-hay-entre-la-ebullicion-y-la-evaporacion
Condensación
La condensación es el cambio del estado gaseoso al líquido. La condensación ocurre cuando baja la temperatura y/o sube la presión en el ambiente.
¿Cómo ocurre la condensación? Cuando la temperatura desciende y/o la presión sube, las partículas que conforman el gas comienzan a acercarse unas a otras, de modo que pierden parte de su movilidad. De este modo se produce el cambio del estado gaseoso al líquido.
Ejemplos
- La lluvia.
- La transpiración de un vaso con líquido frío.
- El rocío.
- Empañado de vidrios y espejos.
Sublimación
La sublimación se produce cuando un sólido conservado a una temperatura extremadamente baja entra en contacto con una temperatura mayor, dentro de una presión determinada.
¿Cómo se produce la sublimación? Para todas las sustancias existe un punto de temperatura y presión en que el estado sólido, el líquido y el gaseoso coexisten en equilibro, el cual se llama punto triple.
Cuando la temperatura del estado sólido se encuentra por debajo del punto triple y, además, la presión de vapor es lo suficientemente baja, no existen condiciones para la formación de líquido. Entonces, cualquier aporte de energía (calor), por pequeño que sea, provoca que las partículas del sólido se separen abruptamente y se expandan en el espacio en forma de gas.
Por ejemplo, el hielo seco es un bloque sólido de dióxido de carbono (CO2) y se conserva a una temperatura de -78ºC, es decir, por debajo del punto triple. Cuando el hielo seco se expone a la temperatura del ambiente, a una presión inferior de 5.2 atmósferas, se transforma en gas directamente. Esto es sublimación.
Ejemplos
- Sublimación de hielo seco.
- Sublimación de naftalina.
- Sublimación de tinta.
- Sublimación química para medicamentos.
¿Cuáles son las leyes de la fusión?
- ¿Qué cantidad de calor será necesario entregarle a 23 gramos de hierro para que eleve su temperatura desde 23°C hasta 45°C?
Es importante tener en cuenta los datos que nos ofrece el enunciado. Luego, aplicar la fórmula que se nos ofreció en la ecuación (I).
Datos:
Reemplacemos en la ecuación (I):
De esta forma, vemos que es necesario entregarlo 58,19 cal de energía a 23 g de hierro a 23°C para que eleve su temperatura hasta 45°C.



